 |
La ecuación que describe normalmente la relación entre la presión, el volumen, la temperatura y la cantidad (en moles) de un gas ideal es:
Donde:
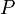 = presion absoluta
= presion absoluta = Volumen
= Volumen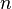 = Moles de gas
= Moles de gas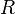 = constante universal de los gases ideales
= constante universal de los gases ideales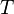 = Temperatura absoluta
= Temperatura absoluta
Teoría cinética molecula
Esta teoría fue desarrollada por Ludwith Boltzmann y Maxwell. Nos indica las propiedades de un gas ideal a nivel molecular.
- Todo gas ideal está formado por N pequeñas partículas puntuales (átomos o moléculas).
- Las moléculas gaseosas se mueven a altas velocidades, en forma recta y desordenada.
- Un gas ideal ejerce una presión continua sobre las paredes del recipiente que lo contiene, debido a los choques de las partículas con las paredes de este.
- Los choques moleculares son perfectamente elásticos. No hay pérdida de energía cinética.
- No se tienen en cuenta las interacciones de atracción y repulsión molecular.
- La energis cinetica media de la translación de una molécula es directamente proporcional a la temperatura absoluta del gas.
En estas circunstancias, la ecuación de los gases se encuentra teóricamente:
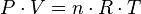
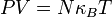
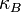 es la constante de
es la constante de
No hay comentarios:
Publicar un comentario