Virus de Epstein-Barr
 |
Los niños se vuelven susceptibles al virus tan pronto como la protección de los anticuerpos maternos desaparece.
VIROLOGÍA
Estructura y genoma
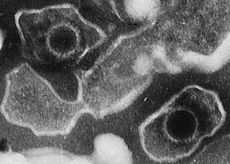
Una partícula madura del virus de Epstein-Barr tiene un diámetro de entre 120 nm y 180 nm. Se compone de una doble hebra de ADN lineal encerrado por una cápside proteica. La cápside está rodeada por un tegumento de proteínas, que a su vez está rodeado por una envoltura lipídica.
El genoma del virus es de alrededor de 192000 pares de bases de longitud y contiene aproximadamente 85 genes.
La envoltura viral se integra con glicoproteínas esenciales para la entrada viral en la célula.
En ensayos de laboratorio y en animales realizados en el año 2000, se demostró que tanto el antagonismo de la inhibición del crecimiento mediada por RA y la promoción de la proliferación de LCL se invirtieron de manera eficiente mediante el receptor de glucocorticoides (GR) antagonista RU486.
Tropismo
El término tropismo viral se refiere a los tipos de células que infecta el virus. El virus de Epstein-Barr puede infectar a diferentes tipos de células, incluyendo las células B y las células epiteliales. En ciertos casos, puede infectar a las células T, las células asesinas naturales (NK), y las células musculares lisas.
Los complejos glicoproteicos virales de tres partes de gHgLgp42 median la fusión de membranas de las células B, mientras que los complejos de dos partes de gHgL median la fusión de membranas de las células epiteliales. Los virus de Epstein-Barr que se producen en las células B tienen números bajos de complejos gHgLgp42 cuando los complejos de tres partes interactúan con HLA de clase II en el retículo endoplásmico y son degradados. En contraste, los virus de Epstein-Barr producidos a partir de células epiteliales son ricos en complejos de tres partes, porque estas células no tienen MHC de clase II. Como resultado, los virus producidos a partir de células B son más infecciosos para las células epiteliales, y los virus producidos a partir de las células epiteliales son más infecciosos para las células B.
Ciclo de replicación
Entrada a la célula
El virus de Epstein-Barr puede infectar tanto a células B como a células epiteliales. Los mecanismos para entrar en estas dos células son diferentes.
Para entrar en las células B, la glicoproteína viral gp350 se une al receptor celular CD21 (también conocido como CR2). A continuación, la glicoproteína viral gp42 interactúa con moléculas celulares MHC de clase II. Esto desencadena la fusión de la envoltura viral con la membrana de la célula epitelial, lo que permite entrar al virus en la célula B.
Para entrar en las células epiteliales, la proteína viral BMRF-2 interactúa con las integrinas β1 celulares. Entonces, la proteína viral gH/gL interactúa con las integrinas celulares αvβ6/8. Esto desencadena la fusión de la envoltura viral con la membrana de la célula epitelial, lo que le permite al virus entrar en la célula epitelial. A diferencia de la entrada en células B, la entrada en células epiteliales en realidad es impedida por la glicoproteína viral gp42.
Una vez el virus entra en la célula, la cápside viral se disuelve y el genoma viral es transportado al núcleo de la célula.
Replicación lítica
El ciclo lítico, o infección productiva, da como resultado la producción de viriones infecciosos. El virus de Epstein-Barr puede someterse a replicación lítica tanto en las células B como en las células epiteliales. En las células B, la replicación lítica sólo tiene lugar normalmente después de la reactivación a partir de la latencia. En las células epiteliales, la replicación lítica a menudo sigue directamente a la entrada del virus.
Para que se produzca la replicación lítica, el genoma viral debe ser lineal. El genoma del virus latente es circular, por lo que se debe linealizar en el proceso de reactivación lítica. Durante la replicación lítica, la ADN polimerasa viral es responsable de la copia del genoma viral. Esto contrasta con la latencia, en la que la ADN polimerasa de la célula huésped copia el genoma viral.
Los productos génicos líticos se producen en tres fases consecutivas: temprana-inmediata, temprana y tardía.
- Productos génicos líticos tempranos-inmediatos. Actúan como transactivadores, aumentando la expresión de genes líticos más tarde. Estos productos génicos incluyen el BZLF1 (también conocido como Zta y ZEBRA) y el BRLF1.
- Productos génicos líticos tempranos. Tienen muchas más funciones, tales como la replicación, el metabolismo, y el bloqueo del procesamiento de antígenos. Los primeros productos de los genes líticos tempranos incluyen el BNLF2.
- Productos génicos líticos tardíos. Tienden a ser proteínas con funciones estructurales, como la VCA, que forma la cápside viral. Otros productos genéticos líticos tardíos, tales como el BCRF1, ayudan al virus a evadir el sistema inmune.
A diferencia de la replicación lítica de muchos otros virus, la del virus de Epstein-Barr no lleva inevitablemente a la lisis de la célula huésped debido a que los viriones son producidos por gemación a partir de la célula infectada. Las proteínas líticas incluyen la gp350 y la gp110.
Latencia
A diferencia de la replicación lítica, la latencia no resulta en la producción de viriones. En su lugar, el genoma del virus se circulariza, reside en el núcleo de la célula como un episoma, y es copiado por la ADN polimerasa celular. En latencia, sólo una parte de los genes del virus se expresan.
El virus latente expresa sus genes en uno de los tres patrones conocidos como programas de latencia. El virus latente puede persistir de forma latente dentro de las células B y las células epiteliales, pero son posibles diferentes programas de latencia en los dos tipos de células.
El virus de Epstein-Barr puede presentar uno de los siguientes tres programas de latencia: Latencia I, Latencia II, o Latencia III. Cada programa de latencia conduce a la producción de un conjunto limitado y distinto de proteínas virales y ARN virales.
| Gen expresado | EBNA-1 | EBNA-2 | EBNA-3 A | EBNA-3 B | EBNA-3 C | EBNA-LP | LMP-1 | LMP-2 A | LMP-2 B | EBER |
|---|---|---|---|---|---|---|---|---|---|---|
| Producto | Proteína | Proteína | Proteína | Proteína | Proteína | Proteína | Proteína | Proteína | Proteína | ncARNs |
| Latencia I | + | - | - | - | - | - | - | - | - | + |
| Latencia II | + | - | - | - | - | + | + | + | + | + |
| Latencia III | + | + | + | + | + | + | + | + | + | + |
También se postula que existe un programa en el que se apaga toda la expresión de proteínas virales (Latencia 0).
Dentro de las células B, los tres programas de latencia son posibles. El virus latente dentro de las células B normalmente pasa de Latencia III, a Latencia II y luego a Latencia I. Cada etapa de latencia influye únicamente en el comportamiento de las células B. Al infectar una célula B nueva en reposo, el virus entra en Latencia III. El conjunto de proteínas y ARNs producidos en Latencia III transforma la célula B en una explosión de proliferación (también conocida como activación de células B). Más tarde, el virus restringe su expresión génica y entra en Latencia II. El conjunto más limitado de proteínas y ARNs producidos en Latencia II induce a la célula B a diferenciarse en una célula B de memoria. Finalmente, el virus restringe la expresión de genes aún más y entra en Latencia I. La expresión de EBNA-1 permite que el genoma del virus se replique cuando la célula B de memoria se divide.
Dentro de las células epiteliales, sólo es posible la Latencia II. En la infección primaria, el virus de Epstein-Barr se replica en las células epiteliales orofaríngeas y establece las infecciones en Latencia III, II y I en los linfocitos B. La infección de los linfocitos B por el virus latente es necesaria para la persistencia del virus, para la replicación posterior en las células epiteliales, y para la liberación de virus infeccioso en la saliva. Las infecciones de los linfocitos B por parte del virus en Latencia III y II, la infección de las células epiteliales orales por el virus en Latencia II, y la infección en Latencia II de las células NK o de las células T, puede dar lugar a enfermedades malignas, caracterizadas por la presencia uniforme del genoma del virus y expresión génica.
Reactivación
El virus latente en las células B puede ser reactivado para cambiar a replicación lítica. Se sabe que esto sucede in vivo, pero no se conoce con precisión cómo se desencadena. In vitro, el virus latente en las células B puede ser reactivado mediante la estimulación del receptor de células B, por lo que la reactivación in vivo probablemente tiene lugar cuando las células B infectadas de forma latente responden a infecciones no relacionadas. In vitro, el virus latente en las células B también puede ser reactivado mediante el tratamiento de las células con butirato de sodio o TPA.
Transformación de los linfocitos B
Cuando el virus de Epstein-Barr infecta a las células B in vitro, las líneas de células linfoblastoides que eventualmente emergen son capaces de un crecimiento indefinido. La transformación del crecimiento de estas líneas celulares es la consecuencia de la expresión de la proteína viral.
Los genes EBNA-2, EBNA-3C y LMP-1 son esenciales para la transformación, mientras que el EBNA-LP y el EBER no lo son.
Se postula que tras una infección natural con el virus, éste ejecuta algunos o todos de sus programas de expresión génica para establecer una infección persistente. Dada la ausencia inicial de inmunidad del huésped, el ciclo lítico produce grandes cantidades de virus para infectar a otros (presumiblemente) linfocitos B dentro del huésped.
Los programas latentes reprograman y subvierten a los linfocitos B infectados para que proliferen y produzcan células infectadas en los sitios en que el virus presumiblemente persiste. Finalmente, cuando se desarrolla la inmunidad del huésped, el virus persiste apagando la mayoría de sus genes (o posiblemente todos), reactivándose sólo de vez en cuando para producir nuevos viriones. Un equilibrio se alcanza finalmente entre la reactivación viral ocasional y la vigilancia inmune del huésped, eliminando las células que activan la expresión génica viral.
El sitio de persistencia del virus puede ser la médula ósea. Los pacientes positivos para el virus de Epstein-Barr a quienes se les reemplaza su propia médula ósea con la de un donante negativo para el virus, dan negativo a su vez después del trasplante.
Antígenos latentes
Todas las proteínas nucleares del virus de Epstein-Barr son producidas mediante corte y empalme alternativo de un transcripto primario, ya sean los promotores Cp o los Wp en el extremo izquierdo del genoma (en nomenclatura convencional). Los genes se ordenan dentro del genoma en la secuencia: EBNA-LP/EBNA-2/EBNA-3A/EBNA-3B/EBNA-3C/EBNA-1.
El codón de iniciación de la región de codificación EBNA-LP es creado por un corte y empalme alternativo del transcripto de la proteína nuclear. En ausencia de este codón de iniciación, la secuencia EBNA-2/EBNA-3A/EBNA-3B/EBNA-3C/EBNA-1 se expresa dependiendo de cuál de estos genes se empalme alternativamente en la transcripción.
Proteínas / genes
| Proteína / gen / antígeno | Etapa | Descripción |
|---|---|---|
| EBNA-1 | latente+lítico | La proteína de EBNA-1 se une a un origen de replicación (oriP) en el genoma viral y media la replicación y la partición del episoma durante la división de la célula huésped. Es la única proteína viral expresada durante la latencia grupo I. |
| EBNA-2 | latente+lítico | El EBNA-2 es el principal transactivador viral. |
| EBNA-3 | latente+lítico | Estos genes también se unen a la proteína RBP-J del huésped. |
| LMP-1 | latente | LMP-1 es una proteína transmembrana de seis lapsos que también es esencial para la transformación del crecimiento mediada por el virus. |
| LMP-2 | latente | LMP-2A y LMP-2B son proteínas transmembrana que actúan para bloquear la señalización de la tirosina quinasa. |
| EBER | latente | EBER-1 y EBER-2 son pequeños ARN nucleares, que se unen a determinadas partículas de nucleoproteína, permitiendo la unión a PKR (dsRNA dependiente de la proteína quinasa serina/treonina), inhibiendo así su función. Las partículas EBER- también inducen la producción de IL-10 que potencia el crecimiento e inhibe las células T citotóxicas. |
| miRNAs | latente | Los microARNs del virus son codificados mediante dos transcripciones, un juego en el gen BART y otro conjunto cerca del grupo BHRF1. Los tres miRNAs BHRF1 se expresan durante la latencia tipo III, mientras que el gran grupo de miRNAs BART (hasta 20 miRNAs) se expresan durante la latencia de tipo II. Las funciones de estos miRNAs se desconocen. |
| EBV-EA | lítico | antígeno precoz |
| EBV-MA | lítico | antígeno de membrana |
| EBV-VCA | lítico | antígeno de la cápside viral |
| EBV-AN | lítico | nucleasa alcalina |
Subtipos de virus de Epstein-Barr
Los virus de Epstein-Barr (VEB) se pueden dividir en dos tipos principales: de tipo 1 y de tipo 2. Estos dos subtipos tienen diferentes genes EBNA-3. Como resultado, los dos subtipos difieren en sus capacidades de transformación y de reactivación. El tipo 1 es dominante en casi todo el mundo, pero los dos tipos son igualmente prevalentes en África.
Se puede distinguir el tipo 1 del tipo 2 cortando el genoma viral con una enzima de restricción y comparando los patrones de digestión resultantes mediante electroforesis en gel.
PAPEL EN LA ENFERMEDAD
El virus de Epstein-Barr ha sido implicado en varias enfermedades que incluyen la mononucleosis infecciosa (enfermedad del beso), el linfoma de Burkitt, el linfoma de Hodgkin, el carcinoma nasofaríngeo y la esclerosis múltiple.
HISTORIA
El virus de Epstein-Barr debe su nombre a Michael Anthony Epstein, profesor emérito de la Universidad de Bristol y a Yvonne Barr, que descubrió y documentó el virus.
En 1961, Michael Anthony Epstein, un patólogo y experto microscopista electrónico, asistió a una conferencia titulada "Los cánceres más comunes en los niños de África tropical - Un síndrome no reconocido hasta ahora." Esta conferencia, de Denis Burkitt Parsons, un cirujano que operaba en Uganda, fue la descripción de la "variante endémica" (forma pediátrica) de la enfermedad que lleva su nombre.
En 1963, un espécimen fue enviado desde Uganda al Hospital de Middlesex para ser cultivado. Las partículas virales fueron identificadas en las células cultivadas, y los resultados fueron publicados en The Lancet en 1964 por Epstein, Bert Achong, y Barr. Las líneas celulares fueron enviadas a Werner y Gertrude Henle en el Hospital de Niños de Filadelfia, quienes desarrollaron los marcadores serológicos. En 1967, un técnico de su laboratorio se infectó con mononucleosis y fueron capaces de comparar una muestra almacenada de suero, mostrando esos anticuerpos para el virus desarrollado.
En 1968, se descubrió que el virus puede directamente inmortalizar las células B después de la infección, imitando algunos tipos de infecciones relacionadas, y confirmando el vínculo entre el virus y la mononucleosis infecciosa.
INVESTIGACIÓN
El virus de Epstein-Barr es relativamente complejo y todavía no es completamente entendido. Laboratorios de todo el mundo continúan estudiando el virus y desarrollando nuevas formas de tratar las enfermedades que provoca. Una manera popular de estudiar este virus in vitro es el uso de cromosomas artificiales bacterianos.
El virus de Epstein-Barr y su virus hermano KSHV pueden ser mantenidos y manipulados en laboratorio en latencia continua. Mientras que muchos virus se asume que tienen esta propiedad durante la infección de su huésped natural, no tienen un sistema de fácil manejo para estudiar esta parte del ciclo de vida viral. Los estudios de genómica del virus han sido capaces de explorar la reactivación lítica y la regulación del episoma viral latente.